2.1. Nabelschnurblut von Geburten
2.2. Nabelschnurblut von Abtreibungen
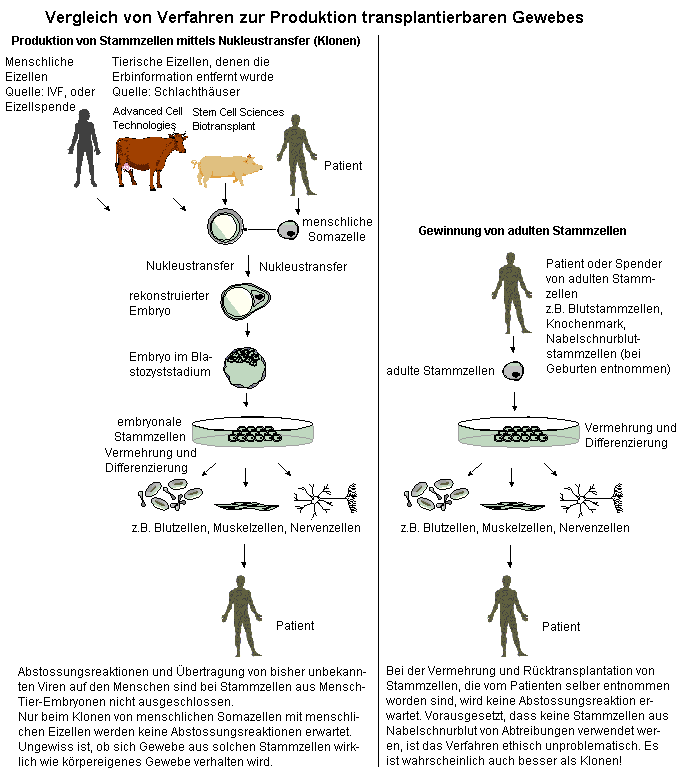
3. Abbildung: Geklonte Stammzellen versus adulte Stammzellen
Stammzellen sind nicht spezialisierte Zellen. Insofern unterscheiden sie sich von den als Somazellen bezeichneten Zellen. Bezüglich des Entwicklungspotentials unterscheiden sich die Stammzellen von Somazellen wesentlich. Aus Somazellen können nur Zellen gleichartigen Typs entstehen, sofern sie überhaupt teilbar sind. Stammzellen haben hingegen die Potenz sich in verschiedenartige Zelltypen zu entwickeln. Deshalb werden sie als pluripotent bezeichnet. Während Somazellen spezialisierte Zellen sind, die sich, Teilbarkeit vorausgesetzt, lediglich wieder in gleichartige spezialisierte Zellen teilen können, haben Stammzellen ein ganz anderes Entwicklungspotential. Je nach Herkunft unterscheidet man embryonale von fetalen und adulten (von Säuglingen, Kindern und Erwachsenen) Stammzellen. Diese sind einerseits in der Lage, sich selber zu vermehren, ohne ihre Pluripotenz zu verlieren und andererseits sich in spezialisierte, organspezifische Zellen auszudifferenzieren.
1.1. Embryonale Stammzellen (ES-Zellen)
Es gibt embryonale Stammzellen, die totipotent sind. Sie können sich, wenn sie aus dem Zellverband des Embryos herausgelöst werden als eigenständiges Individuum weiterentwickeln. In der Natur geschieht das spontan, wenn sich ein Embryo zu sogenannten eineiigen Zwillingen teilt und weiterentwickelt. Beim Menschen endet vermutlich die Totipotenz der Blastomeren spätestens im Achtzellstadium. Allerdings herrscht darüber in der Wissenschaft keine Einigkeit.
Embryonale Stammzellen, die höher entwickelten Stadien entnommen werden, sind demnach nicht mehr totipotent, sondern pluripotent. Sie haben zwei Fähigkeiten: Die Vermehrbarkeit und die Eigenschaft in verschiedenste Zelltypen differenzieren zu können. Bei ihrer Vermehrung ist darauf zu achten, daß sie ihre Pluripotenz bewahren, um sie danach gezielt in eine gewünschte Richtung differenzieren zu lassen. Die Stammzellforschung ist ein im Aufschwung befindlicher Forschungszweig, der erst in den letzten Jahren überraschende Resultate hervorgebracht hat.
Es ist naheliegend, dass zur Gewinnung von embryonalen Stammzellen die betreffenden Embryonen vernichtet werden. Dies trifft für jede Zeugungsart zu (geklont, nach IVF oder ICSI) und ist unabhängig vom Entwicklungsstadium.
Pro Stammzelllinie werden 30 und mehr Embryonen geopfert
Für die Herstellung einer einzigen embryonalen Stammzelllinie müssen 30 und mehr Embryonen geopfert werden. Thomson benötigte für seinen ersten gelungenen Versuch, den er 1998 publizierte 36 frische oder gefrorene Embryonen, um 5 Stammzelllinien herzustellen. Man bedenke, dass es sich um einen erfahrenen Stammzellforscher handelte. Das Team um Lanzendorf erzeugte im Jahr 2000 aus 101 extra zu Forschungszwecken gezeugten frischen Embryonen gerade einmal drei Stammzelllinien. Er arbeitete (aus der Sicht der Forscher) unter optimalsten Bedingungen und verbrauchte pro Stammzelllinie 33 Embryos. Embryonen, die längere Zeit tiefgefroren wurden, haben schlechtere Überlebenschancen bis zum Blastozyststadium als frische. Daher ist die Schätzung von 30 Embryonen pro Stammzelllinie auf der vorsichtigen Seite.
Liste jener Stammzelllinien, deren Verwendung in den USA via National Institutes of Health (NIH) mit staatlichen Forschungsgeldern unterstützt werden:
Man beachte, dass seit August 2001 sechs Stammzellinien offenbar den Besitzer gewechselt haben. Sie gingen von der Monash University zur Firma ES Cell International über. Die Biotechfirma Geron meldete neu 7 Stammzelllinien. Die Universiät Göteborg hat offenbar ihre Stammzelllinien in eine eigene Firma namens Cell Therapeutics Scandinavia ausgegliedert. Dabei fällt auf, dass von ursprünglich 19 Stammzelllinien nur noch 5 angegeben werden.
| Forschungsinstitution | Anzahl an NIH gemeldete Stammzelllinien (Aug 2001) |
Anzahl an NIH gemeldete Stammzelllinien (Nov. 2001)
|
Anzahl an NIH gemeldete Stammzelllinien, lieferbar (Dez. 2003)
|
| BresaGen, Inc., Athens, Georgia, USA (www.novocell.com)* |
4
|
4
|
4
|
| Cell & Gene Therapy Research Institute (Pochon CHA University, Südkorea) |
2
|
||
| Cell Therapeutics Scandinavia (Göteborg University, Schweden) |
5
|
||
| CyThera, Inc., San Diego, California (www.novocell.com) |
9
|
9
|
9
|
| ES Cell International, Melbourne, Australien |
|
6
|
6
|
| Geron, California, USA |
|
7
|
7
|
| Karolinska Institute, Stockholm, Schweden |
5
|
6
|
6
|
| MizMedi Hospital—Seoul National University |
1
|
||
| Maria Biotech Co. Ltd.—Maria Infertility Hospital Medical Institute, Südkorea |
3
|
||
| Monash University, Melbourne, Australien |
6
|
-
|
|
|
National Center for Biological Sciences, Bangalore, Indien |
3
|
3
|
3
|
| Reliance Life Sciences, Mumbai, Indien |
7
|
7
|
7
|
|
Technion-Israel Institute of Technology, Haifa, Israel |
4
|
4
|
8
|
|
University of California, San Francisco, California, USA |
2
|
2
|
2
|
| Göteborg University, Göteborg, Schweden |
19
|
19
|
?
|
|
Wisconsin Alumni Research Foundation, Madison, Wisconsin, USA |
5
|
5
|
5
|
|
|
64
|
72
|
68
|
*Offenbar liefern nur jene Firmen, die hier fett markiert sind an auswärtige Forscher.
Bisher wurde den embryonalen Stammzellen lediglich Pluripotenz und nicht Totipotenz nachgesagt, d.h. aus ihnen sollen keine neuen Embryonen heranwachsen können. Allerdings gab es da einmal Versuche (1996) mit embryonalen Stammzellen des Weissbüscheläffchens. Als sie dicht beisammen kultiviert wurden, ergab sich ein Gebilde, das einem frühen implantierten Embryo glich: Eine zweischichtige Keimscheibe mit Amnion und Dottersack wurde sichtbar. Dieses Experiment wurde in James Thomsons Labor, der später (1998) die erste menschliche embryonale Stammzelllinie hergestellt hat, durchgeführt. Die Frage stellt sich nun, ob die bisherige Annahme der Pluripotenz revidiert werden muss. Forscher der Stammzellfirma Cythera beobachteten nämlich, dass sich um menschliche embryonale Stammzellen spontan Ringe von Plazentazellen bildeten, als ob sie Kontakt zum Mutterleib suchten. Amerikanische Forscher haben nicht nur entdeckt, dass sich aus embryonalen Stammzellen aus Mäusen Eizellen entwickeln, sondern dass diese sich zu Frühstadien neuer Embryonen fortentwickeln können. Nun ergänzt das Magazin New Scientist den Befund der Entstehung von Eizellen aus embryonalen Stammzellen mit der Meldung, das Team um Toshiaki Noce am Mitsubishi Kagaku Institute of Life Sciences in Tokyo habe embryonale Stammzellen von männlichen Mäusen kultiviert. Diese hätten begonnen sich in Keimzellen zu verwandeln. Das Team transplantierte die Vorläuferzellen in Hodengewebe, woraus sich drei Monate später normale Spermien entwickelten. Damit rückt die unerfreuliche Aussicht, künstliche Eizellen könnten mit normalen Samenzellen und umgekehrt normale Eizellen mit künstlichen Samenzellen befruchtet werden, näher. Zwar handelt es sich hier um Versuche bei Mäusen, doch wäre es naiv, nicht mit der Anwendung beim Menschen zu rechnen. Klar würde auch ein solches Verfahren, ebenso wie die herkömmliche In-vitro-Fertilisation, der Würde der menschlichen Fortpflanzung widersprechen. Es ist daher als ethisch verwerflich abzulehnen.
Primordiale Keimzellen werden aus den Embryonen in der Regel anlässlich von Abtreibungen gewonnen. Diese Stammzellen (embryonic germ cells, EG-Zellen) bilden die Anlage für die Keimzellen. Je nach Typ der eingesetzten Wachstumsfaktoren sind daraus wie bei den ES-Zellen schon ganz unterschiedliche Zelltypen, wie Herz-, Nerven-, Blut-, Muskel- und Knorpelzellen hergestellt worden
Denkbar und ethisch weniger problematisch wäre die Verwendung von Stammzellen von spontanen Aborten. Dieses Gewebe ist aber weniger gut zugänglich und nicht in jener Menge verfügbar (!), wie jenes von Abtreibungen. Es gibt in den USA Firmen, die sich auf die Verteilung von fetalem Gewebe aus Abtreibungen spezialisiert haben, um einerseits das Gewebe "reinzuwaschen" und andererseits der Forschung verfügbar zu machen. In Publikationen geben Forscher teilweise nur noch die Firma als Lieferanten an und verzichten darauf anzugeben, dass das verwendete Gewebe aus Abtreibungen stammt.
Das Entwicklungspotential von adulten Stammzellen ist nach dem gegenwärtigen Forschungsstand gegenüber fetalen und embryonalen Stammzellen reduziert. Sie werden deshalb oft als multipotent bezeichnet. Auch sie können mittels Wachstumsfaktoren dazu angeregt werden, sich in einen spezialisierten Zelltyp zu entwickeln. Adulte Stammzellen aus Knochenmark konnten schon über ein Jahr lang vermehrt werden (bis 80 Zellteilungen), ohne dass die Pluripotenz verloren ging. Es wurde gezeigt, dass sich die kultivierten Stammzellen zu verschiedenen Zelltypen entwickeln liessen. Neu an diesen Studien ist die Erkenntnis, dass sich abhängig von den Kultivierungsbedingungen aus nicht-blutbildenden Zellen des Knochenmarks sogenannte mesodermale Progenitor Zellen (MPC's) bilden. Diese Zellen können sowohl die Blutbildung unterstützen als auch verschiedene Typen von Bindegewebe wie Knorpel- und Knochengewebe bilden.
Adulte Stammzellen können manchmal auch vom Patienten selber entnommen, behandelt und wieder zurücktransplantiert werden. Das ist ein unbestreitbarer Vorteil. Es gibt keine Abstossungsreaktionen, wie wenn etwa embryonale oder fetale Stammzellen verwendet würden. Es sind aber auch Transplantationen zwischen Verwandten oder - nach entsprechenden Abklärungen - zwischen unverwandten Personen möglich. Damit haben sie jenen Vorzug, den man Stammzellen zuschreibt, die mit dem Erbgut des Patienten geklont worden sind. Im Vergleich zu jenen Stammzellen, die geklonten Ursprungs sind, kommen adulte Stammzellen meistens direkt vom Patienten und etwaige genetische Veränderungen, die von der sogenannten "Umprogrammierung" herkommen könnten, sind ausgeschlossen. Zudem enthalten mittels Nukleustransfer geklonte Stammzellen Mitochondrien der Spendereizellen. Die Mitochondrien machen ca. 1% der menschlichen Erbsubstanz aus. Geklonte Stammzellen würden somit doch noch fremde Erbsubstanz enthalten und weisen deshalb nicht jene Übereinstimmung auf, die den vom Patienten entnommenen adulten Stammzellen eigen sind.
Bemerkenswerte Heilungserfolge wurden in letzter Zeit bei Herzinfarktpatienten mit adulten Stammzellen aus Knochenmark erzielt. Dazu wurden den Patienten eigene Stammzellen zur Erneuerung des Herzgewebes eingespritzt. Mit adulten Stammzellen aus Knochenmark und Nabelschnurblut sind schon viele Patienten von schweren Krankheiten (z.B. Leukämie) geheilt worden. Von solchen Resultaten ist die Forschung an embryonalen Stammzellen und erst recht jene, die auf Klontechniken basieren, noch weit entfernt.
Es ist nicht einzusehen, weshalb angesichts der Fortschritte in der Forschung mit adulten Stammzellen, viele Forscher nach wie vor am "therapeutischen" Klonen festhalten wollen. Die Risiken, die sich durch den Nukleustransfer ergeben, sind bisher noch nicht abschätzbar. Werden sich geklonte Stammzellen und das daraus produzierte Gewebe genaus so verhalten wie Gewebe, das vom Patienten selber stammt? Die Erfahrungen, die beim reproduktiven Klonen gemacht worden sind, stimmen alles andere als zuversichtlich. Schliesslich werden lediglich 1% der rekonstruierten Embryonen geboren. Die Todesrate nach der Geburt beträgt rund 50%. Dies muss eine Ursache haben, die sich durchaus auch auf die erzeugten Stammzellen und dessen Gewebe negativ auswirken kann. Rational ist das Festhalten am "therapeutischen" Klonen nur erklärbar, wenn die betreffenden Forscher langfristig doch den Menschen "reproduktiv" klonen wollen. Das "therapeutische" Klonen wird jene Erfahrungen ermöglichen, die zur Verbesserung der äusserst hohen Misserfolgsquoten der "reproduktiven" Klonens führen werden.
1.4. Stammzellen aus parthenogenetisch erzeugten Embryonen
Im wörtlichen Sinn heisst Parthenogenese "Jungfernzeugung". Gemeint ist eine Entwicklung von Embryonen aus Eizellen, die nicht befruchtet wurden. Die reife Eizelle ist diploid, d.h. sie enthält noch zwei Chromosomensätze. Bei der Befruchtung mit einer Samenzelle wird der zweite in der Form eines Polkörperchens ausgestossen, so dass die befruchtete Eizelle nach dem ganzen Befruchtungsvorgang diploid ist. Bei der Parthenogenese gibt es zwei Varianten. Wenn die Eizelle physikalisch oder chemisch aktiviert wird, stösst sie den zweiten Chromosomensatz aus und ist haploid. Ihre Entwicklungspotenz reicht nur bis zu einem mehrzelligen "embryonalen Stadium.
Die Biotechfirma Advanced Cell Technology (ACT) ist vor allem wegen ihrer Tabubrüche, wie der Erzeugung von Mensch-Rind-Embryonen und von geklonten menschlichen Embryonen zwecks Produktion von menschlichen Stammzellen berüchtigt. Sie hat menschliche Embryonen parthenogenetisch gezeugt, wobei der Austoss des zweiten Chromosomensatzes verhindert wurde. In der etwas fragwürdigen Publikation im Journal of Regenerative Medicine behauptet ACT, das sechszellige embryonale Stadium sei mit dieser Methode erreicht worden.
Nun hat ACT in einem vielzitierten Artikel in Science erstmals Stammzellen aus parthenogenetisch erzeugten Blastozysten von Primaten gewonnen. Sie konnten sich ähnlich wie gewöhnliche embryonale Stammzellen in verschiedene Zelltypen differenzieren. Die Publikation gibt auf einer einzigen Seite (!) nur wenig Informationen her. Der Hinweis, dass bei den Experimenten der Ausstoss des zweiten Chromosomensatzes unterdrückt worden ist, kann lediglich dem Kommentar entnommen werden. Leider ist damit zu rechnen, dass dies nach Primaten und Mäusen nach vielen Versuchen auch beim Menschen gelingen wird. Der renommierte Herzspezialist Prof. Axel Haverich hat in einem Interview gegenüber der Deutschen Presse-Agentur diese Methode befürwortet. Er behauptete: "Das Ergebnis zeigt einen Weg auf, um in der Stammzellenforschung das Stadium des Embryos zu vermeiden." Wie er dazu kommt, bleibt sein Geheimnis, denn bei dieser Metlhode werden ganz klar, auch gemäss den Autoren der Publikation, Embryonen gezeugt, - nur nicht normale, sondern abnormale!
Aus menschlichen Eizellen ist es gelungen, Stammzelllinien herzustellen. Allerdings ist der Bedarf an menschlichen Eizellen sehr hoch. Aus 40 Eizellen wurden 23 Blastozysten entwickelt und schliesslich 7 Stammzelllinien generiert (vgl. Cloning & Stem Cells 9 (2007) 432-449).
Ethische Bewertung: Man muss sich im Klaren sein, dass bei dieser Methode ganz bewusst abnormale Embryonen zum Zweck der Stammzellengewinnung erzeugt werden. Sie erfolgt - wie beim Klonen - asexuell und widerspricht der Würde der menschlichen Fortpflanzung. Die Katholische Kirche hat schon 1987 im Dokument 'Donum vitae' die Erzeugung menschlicher Wesen ohne Sexualität (Zwillingsspaltung, Klonierung und Parthenogenese) abgelehnt.
1.5 Induzierte pluripotente Stammzellen aus Somazellen(iPSC)
Die induzierten pluripotenten Stammzellen, werden im Labor erzeugt. Dabei geht man von Zellen aus, die gerade nicht die Eigenschaft von Stammzellen haben: Zum Beispiel menschlichen Hautzellen, die im Gegensatz zu Stammzellen spezialisiert sind. Es handelt sich hier um eine völlig neue Technik, die erstmals 2006 im Tierversuch und Ende 2007 auch mit menschlichen Zellen gelungen ist. Dabei wurden Hautzellen genommen und in diese drei bis vier verschiedene Gene eingeschleust. Ein Gen ist ein Abschnitt in der Erbsubstanz, der für eine bestimmte Funktion verantwortlich ist, z.B. für die Produktion eines Proteins oder für bestimmte Entwicklungsvorgänge. Mehreren unabhängigen Forscherteams gelang es, damit Zellen zu züchten, die sehr ähnliche Eigenschaften aufweisen, wie embryonale Stammzellen. Die Forscher haben in Hautzellen mittels Retroviren drei bis vier Gene eingeschleust und so erreicht, dass die Zellen sich umwandelten und nun Eigenschaften aufweisen, die verblüffend ähnlich sind, wie jene der embryonalen Stammzellen. Weil diese Eigenschaft durch diese Technik erzeugt wurde, spricht man hier von induzierten pluripotenten Stammzellen, abgekürzt iPSC.
Um jeglichen Missverständnissen vorzubeugen. Es wird hier kein Embryo erzeugt, sondern die spezialisierten Zellen werden mit Hilfe der eingeschleusten Gene oder anderer Hilfsmittel in einen Zustand mit pluripotenten Eigenschaften versetzt. Im Tierversuch hat sich die Methode bereits als vielversprechend erwiesen. Bei Mäusen wurde eine Erbkrankheit, die Sichelzellenanämie, erfolgreich mit induzierten pluripotenten Stammzellen, die genetisch korrigiert wurden, behandelt. Dabei soll nicht verschwiegen werden, dass hier noch einige Probleme zu lösen sind, bevor eine Anwendung beim Menschen in Frage kommt. Das Einschleusen der Gene ist gefährlich und könnte u.U. Krebs auslösen, wie das bei einigen Gentherapieversuchen geschehen ist. In letzter Zeit ist es gelungen, zunächst die Anzahl der Gene zu reduzieren und vor allem auf ein Onkogen zu verzichten. Es ist sogar auf verschiedene Wegen gelungen, induzierte pluripotente Stammzellen zu erzeugen, ohne dass genetisches Material von Viren in den Zellen übrig blieb. Auf das Einschleusen der ursprünglich zwei bis vier Gene konnte verzichtet werden. Bereits wurden patientenspezifische iPSC von Parkinsonpatienten produziert und für jeden einzelnen eine Stammzelllinie hergestellt. Zudem konnten aus iPSC retinale Vorläuferzellen gezüchtet werden.
Von einer therapeutischen Anwendung ist man aber noch weit entfernt. Die induzierten pluripotenten Stammzelllinien müssen noch genauer charakterisiert werden und ihr Einsatz darf keine Tumore auslösen, ein Problem das auch für die embryonalen Stammzellen noch ungelöst ist. Außerdem müssen die Kulturen, wie die Forscher schreiben, frei von Seren oder anderen Zusätzen tierischen Ursprungs sein. Übrigens hatte man im Rahmen der IVF für die Kultivierung und Kryokonservierung der menschlichen Embryonen bis vor etwa zehn Jahren anscheinend sorglos tierische Seren (bovine serum albumin etc.) in den Kulturmedien verwendet, und diese erst vor einigen Jahren durch menschliche Seren ersetzt. Es ist zu erwarten, dass induzierte pluripotente Stammzellen, wenn sie aus Gewebe des Patienten hergestellt werden, keine Immunabwehr auslösen. Wenn der Einsatz dieser Stammzellen nicht mit unverhältnismäßigen Risiken für die Empfänger verbunden ist, steht ihnen aus ethischer Sicht nichts im Weg. Allerdings sind Anwendungen denkbar, die aus ethischer Sicht abzulehnen sind.
Zwei Forscherteams aus China und eines aus den USA haben im Juli und August 2009 unabhängige Studien mit Mäusen vorgelegt. Tetraploide Embryonen wurden mit iPSC ergänzt und in Leihmuttermäuse transferiert. Tetraploide Embryonen weisen vier volle Chromosomensätze auf und können nur die Plazenta, aber nicht den eigentlichen Embryo bilden. 0.3 bis 13% der transferierten Embryonen wurden geboren. Ähnliche Resultate sind auch mit embryonalen Stammzellen machbar. Die Studien sind ethisch brisant, denn die Technik könnte auch beim Menschen angewandt werden. Es handelt sich um eine neue Klonmethode, die ohne Eizellen auskommt, sondern nur auf induzierte pluripotente Stammzellen und teraploide Embryonen zurückgreifen muss. Im Gegensatz zum Klonen mittels Nukleustransfer, ist diese Technik einfacher. Aber auch hier starben Mäuse kurz nach der Geburt. Etliche litten an Atemschwierigkeiten und Übergewicht, andere lebten ohne gesundheitliche Probleme bis ins Erwachsenenalter.
Ethische Probleme mit induzierten pluripotenten Stammzellen
Es ist dem Entdecker der iPSC Shinya Yamanaka hoch anzurechnen, dass er in Japan auf das hohe Missbrauchspotenzial der iPSC aufmerksam machte. Das Ministerium für Wissenschaft sprach in einer Mitteilung, die an Universitäten und Forschungsinstitute ging, folgende Verbote aus:
- Implantation von Embryonen, die aus iPSC hergestellt werden in Menschen und Tiere.
- Die Produktion eines Individuums auf irgend einem anderen Weg mit iPSC.
- Die Zugabe von iPSC in einen Embryo oder Fetus, d.h. zur Herstellung von Chimären.
- Die Produktion von Ei- und Samenzellen aus iPSC.
So weit ich festgestellt habe, ist den Philosophen und Ethikern diese Problematik der iPSC noch zu wenig bewusst. Immerhin hat Hans-Werner Denker, emeritierter Prof. für Anatomie und Entwicklungsbiologie von der Uni Duisburg-Essen, darauf hingewiesen. Er bezieht sich auf einen Artikel in „Metaphilosophy“, wo Devolder und Ward ein Verfahren zur Verbesserung der Erfolgsquote im Rahmen der IVF vorschlugen. Zuerst würden embryonale Stammzellen von den IVF-Embryos erzeugt, diese expandiert und gelagert. Nach Wunsch könnten dann jederzeit nach Bedarf via tetraploide Embryokomplementierung identische Embryonen erzeugt und transferiert werden. Das ist aber nichts anderes als eine Klonmethode, die ohne Nukleustransfer auskommt. Die Frage ist, woher die tetraploiden Embryonen beschaffen. Dazu kämen verschiedene Möglichkeiten in Frage, die ich aber hier nicht diskutieren möchte. In der Euphorie über die ständig neuen Resultate und Erkenntnisse mit den iPSC ist die Bereitschaft, die brisanten ethischen Probleme bestimmter Anwendungsbereiche der iPSC zur Kenntnis zu nehmen, anscheinend nicht besonders hoch.
Ethische Bewertung: Induzierte pluripotente Stammzellen weisen als solche keine Entwicklungspotenz eines Embryos auf. Ihre Erzeugung, ihre gezielte Entwicklung in differenzierte Zellen widersprechen den wichtigsten ethischen Prinzipien nicht. Es handelt sich um keine Fortpflanzung und es wird kein Mensch gezeugt, dessen Würde geachtet werden müsste.
Wenn allerdings induzierte pluripotente Stammzellen in entkernte Eizellen transferiert würden, wäre es ethisch verwerflich. Ebenso wenn eine tetraploide Blastozyste durch induzierte pluripotente Stammzellen ergänzt würde. Beides sind neue Klonvarianten. Verwerflich ist die Verwendung von iPSC zur Herstellung von Embryonen bzw. Chimären und auch die Produktion von Ei- und Samenzellen. Falls letzteres gelingen sollte, könnte die Zeugung des Menschen völlig unabhängig von Mann und Frau im Labor durchgeführt werden mit enormen Missbrauchsmöglichkeiten.
Der Anwendungsbereich für den Einsatz von Stammzellen ist noch überhaupt nicht abgesteckt. Sicher kommen jene therapeutischen Methoden in Frage, die bisher mit Knochenmarktransplantationen abgedeckt wurden. Die Forscher erhoffen sich neue Möglichkeiten für die Behandlung von Parkinson, Alzheimer, Blutkrebs und Immunschwächekrankheiten.
2.1 Nabelschnurblut von Geburten
Heute werden in bestimmten Zentren bereits Nabelschnurblutbanken angelegt, die anlässlich der Geburt eines Kindes entnommen werden. Nabelschnurblut ist reich an Blutstammzellen und kann in-utero oder nach der Geburt zugeführt werden. Möglich ist auch einer Verwendung dieses Nabelschnurblutes für die Therapie von Familienangehörigen und - nach entsprechender Abklärung der Verträglichkeit - unverwandten Personen. Die Verwendung von Nabelschnurblut, das eigentlich als "Abfall" bei der Geburt anfällt, ist ethisch nicht problematisch, sofern wichtige Grundsätze eingehalten werden. Die Deutsche Bundesärztekammer hat Richtlinien erlassen, die es nur erlauben ab einem Geburtsgewicht von 1.5 kg Nabelschnurblut zu gewinnen. Weder Mutter noch Kind dürfen durch die Entnahme gefährdet werden.
2.2 Nabelschnurblut von Abtreibungen
Leider wird in den USA und sogar in der Schweiz (!) auch anlässlich von Abtreibungen und Frühgeburten Nabelschnurblut entnommen. Äusserst grosszügige bzw. fehlende Richtlinien machen dies möglich. Die ethische Problematik ist etwa vergleichbar mit jener von der Entnahme fetalen Gewebes bei Abtreibungen.
2.3 Stimulation und Transplantation von Knochenmark
Durch medikamentöse Stimulation kann im gesunden oder kranken Menschen das Knochenmark zur vermehrten Produktion angeregt werden. In einem Kreislauf wird die Stammzellen dem Blut abgeführt. So können ohne schwerwiegenden Eingriff beim Spender Blutstammzellen gewonnen werden, die ähnlich eingesetzt werden können, wie die herkömmlichen Transplantationen von Knochenmarkspenden.
Unlängst ist es Forschern am Stem Cell Institute der University of Minnesota Medical School in Minneapolis (USA) gelungen adulte Stammzellen aus Knochenmark über ein Jahr lang in Kultur zu halten, ohne dass sie sich differenzierten. Es wurden über 60 Zellteilungen erreicht ohne dass sich die Pluripotenz der Zellen verminderte. Die Forscher zeigten zudem, dass sich die kultivierten Stammzellen zu verschiedenen Zelltypen entwickeln liessen. Sollten sich die Resultate von anderen Forschern reproduzieren lassen, wäre ein Argument für die Forschung mit embryonalen Stammzellen hinfällig. Bisher wurde behauptet nur embryonale Stammzellen hätten die Fähigkeit sich beliebig in-vitro vermehren zu lassen ohne die Plastizität hin zu verschiedenen Zelltypen zu verlieren. Nun wird es aufgrund dieser neuen Forschungsergebnisse möglich, dass dem Patienten Knochenmark entnommen, in-vitro die enthaltenen Stammzellen vermehrt und schliesslich zu therapeutischen Zwecken dem Patienten in Form von Gewebe wieder zugeführt werden. Zudem Denkbar ist zudem die Verwendung der kultivierten Stammzellen für die Gentherapie.
Ebenfalls vielversprechend ist eine Publikation aus dem Jahr 2000, die die Selektion von speziellen Zellen aus adultem Knochenmark und die anschliessende Differenzierung in neurale Zellen beschreibt.
Beeindruckend sinddie Therapieerfolge, welche Wissenschaftler an der Universität Düsseldorf bei Herzinfarktpatienten und Lebererkrankungen erzielt haben http://medcath.ch/adulte-stammzellen.html.
2.4. Erfolgreiche Gentherapie mit adulten Blutstammzellen
Die Gentherapie hat in den letzten Jahren einige schwere Rückschläge hinnehmen müssen. Unterdessen sind bemerkenswerte Heilungserfolge zu verzeichnen. Dabei kamen adulte Blutstammzellen zu Einsatz, die im Labor genetisch verändert und dann den Patienten zurückgeführt wurden. Im Gegensatz zum "therapeutischen" Klonen, das bisher noch in den Kinderschuhen steckt und noch weit von solchen Erfolgsmeldungen entfernt ist, sind hier erste Resultate vorhanden, die für die weitere Entwicklung der Forschung wichtig sind.
3. Abbildung: Geklonte Stammzellen versus adulte Stammzellen
Quelle und weitere Angaben siehe auch Seite über "therapeutisches" Klonen
![]()
Adulte Stammzellen aus Knochenmark machen embryonalen Stammzellen Konkurrenz (25.06.2002)
Stellungnahme von Dr. med. Santiago Ewig, Poliklinik der Universität Bonn, im Wortlaut:
"HEILUNGSVERSPRECHEN versus MENSCHENWÜRDE: Elemente einer Kritik neuer Biotechnologien"
![]()